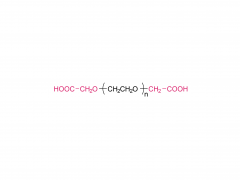
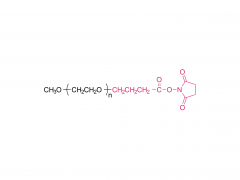
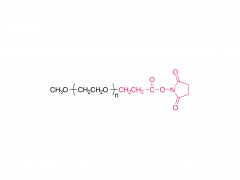
Cultures et produits industriels. Volume 152, 15 septembre 2020, 112497 https://doi.org/10.1016/j.indcrop.2020.112497 Nanoparticules de carboxyméthylcellulose chargées d'avermectine avec des propriétés de réponse aux stimuli et de libération contrôlée Huaxin Zhu, Yue Shen, Jianxia Cui, Anqi wang, Ningjun Li , Chong Wang, Bo Cui, Changjiao Sun, Xiang Zhao, Chunxin Wang, Fei Gao, Shenshan Zhan, Liang Guo, Liang Zhang, Zhanghua Zeng, Yan Wang, Haixin Cui Abstrait Le polyéthylène glycol (PEG) a été introduit dans la carboxyméthylcellulose (CMC) pour former la chaîne hydrophile du PEG-CMC. L'avermectine (Avm) a été greffée sur la longue chaîne de PEG-CMC en utilisant du N, N-dicyclohexylcarbodiimide (DCC) comme déshydratant et de la 4-diméthylaminopyridine (DMAP) comme catalyseur pour former la molécule amphiphile. Ensuite, les nanoparticules d'avermectine ont été préparées avec une libération prolongée sensible à l'estérase avec succès grâce à l'auto-assemblage. La taille des nanoparticules était inférieure à 400 nm. La charge d'avermectine était de 8 % et le taux de dégradation était inférieur à 50 % sous la lampe à arc au xénon pendant 72 h. Comparé à l'avermectine technique, il a montré un avantage anti-photodégradation évident. Par rapport aux granulés dispersibles dans l'eau (WDG) disponibles dans le commerce, les nanoparticules d'avermectine avaient un angle de contact plus petit sur la surface de la feuille de concombre et il y avait une différence significative. Le test de toxicité a montré que les nanoparticules avaient un certain effet insecticide sur la larve d'Hyphantria cunea et la sensibilité augmentait progressivement dans le temps. Produits associés Abréviation : mPEG-CM Nom : Méthoxypoly(éthylène glycol) carboxyméthyle Pour plus d'informations sur les produits, veuillez nous contacter au : US Tel : 1-844-782-5734 US Tel : 1-844-QUAL-PEG CHN Tel : 400-918-9898 Email : sales@sinopeg.com
Afficher plus