Libération du contrôle J. nov. 2024 : 375 : 74-89. est ce que je: 10.1016/j.jconrel.2024.08.049. Publication en ligne le 5 septembre 2024.
Optimisation d'un lieur PEGylé en forme de pendentif pour les conjugués anticorps-médicament
Résumé
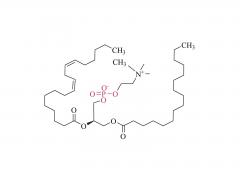
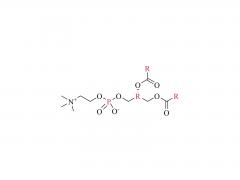
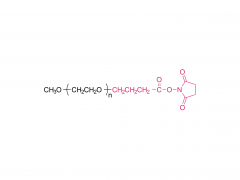
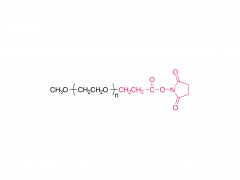
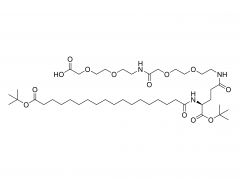
Dans ce travail, nous avons conçu et développé des conjugués anticorps-médicament (ADC) capables de libérer efficacement le médicament après clivage enzymatique du fragment de liaison par les protéases tumorales. Les agents de liaison anticorps-médicament que nous avons utilisés sont le résultat d'une optimisation rationnelle d'un agent de liaison PEGylé précédemment signalé, PUREBRIGHT® MA-P12-PS, qui présentait d'excellentes capacités de chargement de médicament mais manquait d'un mécanisme intégré de décharge de médicament, limitant ainsi la puissance de l'agent de liaison médicamenteux résultant. ADC. Pour remédier à cette limitation, nous avons choisi d'incorporer un déclencheur sensible à la protéase dans le lieur afin de favoriser la libération d'un médicament « sans PEG » à l'intérieur des cellules tumorales et, par conséquent, d'obtenir des ADC puissants. Actuellement, la plupart des ADC commercialisés sont basés sur le dipeptide Val-Cit suivi d'un espaceur auto-immolant pour libérer le médicament sous sa forme non modifiée. Ici, nous avons sélectionné deux séquences peptidiques non traditionnelles, un dipeptide Phe-Gly et un tripeptide Val-Ala-Gly, et avons placé l'une ou l'autre entre le médicament d'un côté (extrémité N) et le reste du lieur, y compris le PEG. moitié, de l’autre côté (C-terminus), sans groupe auto-immolant. Nous avons constaté que les deux agents de liaison répondaient à la cathepsine B, une enzyme lysosomale de référence, et libéraient un catabolite médicamenteux sans PEG, comme souhaité. Nous avons ensuite utilisé les deux agents de liaison pour générer des ADC basés sur le trastuzumab (un anticorps ciblant HER2) et le DM1 (un agent cytotoxique ciblant les microtubules) avec un rapport médicament/anticorps (DAR) moyen de 4 ou 8. Les ADC ont été restaurés. cytotoxicité in vitro, proportionnelle à la charge en DM1 et généralement plus élevée pour les ADC portant Val-Ala-Gly dans leur structure. Dans un modèle murin de cancer de l'ovaire, l'ADC DAR 8 basé sur Val-Ala-Gly s'est mieux comporté que Kadcyla® (un ADC approuvé de DAR 3.5 utilisé comme contrôle tout au long de cette étude), conduisant à une réduction plus élevée du volume tumoral et à une survie médiane plus prolongée. . Pris ensemble, nos résultats décrivent un processus d’optimisation de lieur réussi et encouragent l’application du tripeptide Val-Ala-Gly comme alternative aux autres déclencheurs sensibles à la protéase existants pour les ADC.
Mots clés : Conjugué anticorps-médicament ; Thérapie anticancéreuse ; Lieur peptidique clivable ; Livraison de médicaments ; Optimisation; CHEVILLE.
Pour plus d'informations sur le produit, veuillez nous contacter à :
Tél. aux États-Unis : 1-844-782-5734
Tél. aux États-Unis : 1-844-QUAL-PEG
CHN Tél. : 400-918-9898
E-mail : sales@sinopeg.com