Efficient nanobiocatalytic systems of nuclease P1 immobilized on PEG-NH2 modified graphene oxide: effects of interface property heterogeneity
Wei Zhuang, Linjiao He, Jiahua Zhu, Jianwei Zheng, Xiaojing Liu, Yihui Dong, Jinglan Wu, Jingwei Zhou, Yong Chen, Hanjie Ying
Résumé
L'utilisation de nanofeuilles d'oxyde de graphène (GO) pour le support d'enzymes fonctionnelles a suscité un vif intérêt en raison de leur structure plane unique et de leurs propriétés physiques et chimiques intrigantes. Cependant, les effets détaillés des propriétés d'interface de GO et de ses dérivés fonctionnalisés sur les biomolécules actives ne sont pas bien compris. Nous immobilisons la nucléase P1, une enzyme de production d'acide nucléique industrielle commune, sur des nanofeuillets GO modifiés en poly(éthylène glycol) (PEG-NH2) vierges et amino avec une hétérogénéité des propriétés d'interface en utilisant deux approches, l'adsorption physique et la réticulation chimique. Il est démontré que la nucléase P1 pourrait être immobilisée de manière stable à la surface de GO vierge par adsorption physique et sur le bord de nanofeuillets de GO modifiés par réticulation chimique. La capacité de charge résultante de la nucléase P1 sur le GO vierge est aussi élevée que 6,45 mg/mg en raison de fortes interactions électrostatiques et hydrophobes entre l'enzyme et le support. Cependant, il est déterminé que la résistance aux acides, la stabilité thermique, la réutilisabilité et l'efficacité de dégradation de l'enzyme immobilisée sur GO modifié par PEG-NH2 sont évidemment améliorées par rapport à celles de l'enzyme immobilisée sur GO vierge. Le comportement catalytique amélioré démontre que GO et ses dérivés ont un grand potentiel dans des systèmes biocatalytiques efficaces. la réutilisation et l'efficacité de la dégradation de l'enzyme immobilisée sur GO modifié par PEG-NH2 sont évidemment améliorées par rapport à celles de l'enzyme immobilisée sur GO vierge. Le comportement catalytique amélioré démontre que GO et ses dérivés ont un grand potentiel dans des systèmes biocatalytiques efficaces. la réutilisation et l'efficacité de la dégradation de l'enzyme immobilisée sur GO modifié par PEG-NH2 sont évidemment améliorées par rapport à celles de l'enzyme immobilisée sur GO vierge. Le comportement catalytique amélioré démontre que GO et ses dérivés ont un grand potentiel dans des systèmes biocatalytiques efficaces.
Mots clés : Immobilisation enzymatique ; Oxyde de graphène ; Interface; Modification; Nucléase P(1).
Produits associés
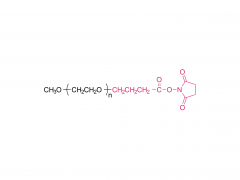
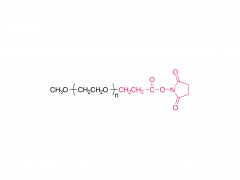
Abréviation : 4 bras PEG-NH2
Nom : 4 bras Poly (éthylène glycol) amine
US Tel : 1-844-782-5734
US Tel : 1-844-QUAL-PEG
CHN Tel : 400-918-9898
Email : sales@sinopeg.com