Les nanoparticules lipidiques (LNP), parmi les vecteurs de nano-administration les plus performants actuellement utilisés, présentent des capacités exceptionnelles pour l'administration de chimiothérapies cytotoxiques, d'antibiotiques et de thérapies à base d'acides nucléiques. Le choix de la structure des lipides pégylés, composant essentiel des LNP, influence de manière déterminante la sécurité, la stabilité et l'immunogénicité de la formulation.
Avez-vous déjà été confronté à des réactions immunitaires déclenchées par le PEG dans les formulations de LNP ? La présence d’anticorps anti-PEG préexistants constitue un obstacle majeur à l’application clinique des médicaments à ARNm. Aujourd’hui, les lipides PEG à terminaisons hydroxyle (HO-PEG) apparaissent comme une solution d’« invisibilité » pour la nouvelle génération de LNP, réduisant considérablement la reconnaissance immunitaire et améliorant l’efficacité de la délivrance. SINOPEG vous propose cette solution. lipides HO-PEG avec des droits de propriété intellectuelle indépendants pour traiter les anticorps anti-PEG préexistants.
SINOPEG : Leader national des lipides HO-PEG
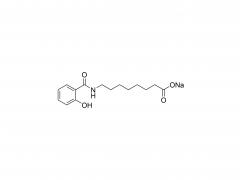
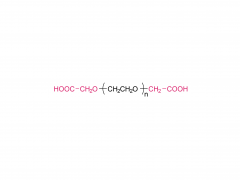
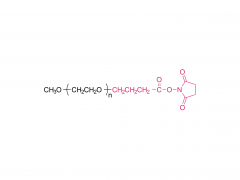
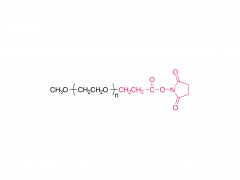
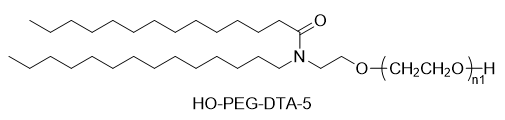
SINOPEG L'entreprise s'est toujours engagée dans la recherche et le développement de nouvelles technologies et de nouveaux produits. Récemment, plusieurs nouvelles structures lipidiques sont disponibles sur étagère, notamment le DTA-5 (brevet n° ZL202280003648.7), un lipide PEG à terminaison hydroxyle, développé indépendamment. Le HO-PEG-DTA-5 bénéficie d'un portefeuille de propriété intellectuelle mondial complet, couvrant les principaux marchés, dont la Chine, les États-Unis et l'Europe. De plus, le dépôt des dossiers de référence de médicament (DMF) pour ce lipide est en voie d'achèvement en Chine et aux États-Unis. Sa structure est la suivante :
Lipides HO-PEG : pourquoi sont-ils le choix privilégié pour les LNP de nouvelle génération ?
Ces dernières années, les lipides PEG à terminaisons hydroxyle (HO-PEG) sont devenus un axe de recherche majeur pour le développement des LNP de nouvelle génération, grâce à leurs avantages significatifs en matière de réduction de l'immunogénicité et d'inhibition de la reconnaissance par les anticorps anti-PEG préexistants. Moderna, leader mondial des thérapies à ARNm, utilise largement ces lipides dans ses nombreuses formulations précliniques et cliniques, confirmant ainsi leur potentiel.
Il y a peu, Moderna a publié dans Nature Communications une étude importante intitulée « Caractérisation du mécanisme d'action des thérapies à ARNm pour le traitement de l'acidémie propionique, de l'acidémie méthylmalonique et de la phénylcétonurie ». Cet article décrit de manière systématique les mécanismes d'action de trois thérapies à ARNm destinées au traitement de maladies métaboliques (dont l'acidémie propionique [AP], l'acidémie méthylmalonique [AMM] et la phénylcétonurie [PCU]) : l'ARNm-3927 (traitement expérimental pour l'AP), l'ARNm-3705 (traitement expérimental pour l'AMM) et l'ARNm-3210 (traitement expérimental pour la PCU). Ces trois thérapies à ARNm utilisent un système d'administration par nanoparticules lipidiques (LNP) et ont démontré des réponses pharmacocinétiques/pharmacodynamiques (PK/PD) favorables chez des souris, notamment une expression accrue de l'ARNm cible, une activité protéique augmentée et une diminution des concentrations des métabolites concernés.
Ces trois thérapies de l'étude utilisaient une formulation LNP unifiée : le lipide cationique était le SM-86 et le lipide PEG était l'OL-56.
Le SM-86 a été mentionné dans des rapports d'évaluation non clinique antérieurs concernant SPIKEVAX®. Ce lipide présente une structure similaire à celle du SM-102 et, lors d'études d'injection intraveineuse chez le rat, ses profils pharmacocinétique, de distribution tissulaire et d'excrétion étaient également similaires à ceux du SM-102. Il correspond au lipide 5 mentionné dans les travaux de recherche antérieurs de Moderna sur les vecteurs lipidiques.
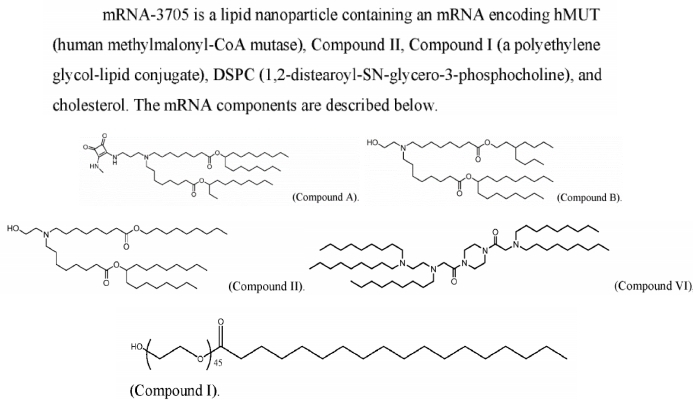
D'après des informations de brevet précédemment divulguées par Moderna, l'OL-56 est décrit comme un dérivé d'acide gras polyéthylène glycolé (appartenant à la structure de formule (VI)), caractérisé par un groupe hydroxyle terminal (-OH) sur le PEG, c'est-à-dire un lipide HO-PEG. Ce type de lipide PEG a été utilisé en association avec divers lipides ionisables (tels que les composés A, B, II, VI, etc.) dans de nombreux documents de brevets, démontrant une bonne compatibilité et une efficacité de délivrance satisfaisante. Le brevet WO2022246020A1 divulgue la formulation de l'ARNm-3705, confirmant que le composé I décrit dans ce brevet est bien l'OL-56 mentionné dans l'article.
À partir de données pharmacocinétiques (PK) et pharmacodynamiques (PD) issues de modèles murins précliniques, l'équipe de recherche a développé des modèles PK/PD précliniques pour chaque thérapie à ARNm. Ces modèles ont ensuite été appliqués avec succès à la prédiction de la dose chez l'humain grâce à une extrapolation allométrique des paramètres. Plus précisément, pour les études sur l'acidémie propionique (AP) et l'acidémie méthylmalonique (AMM), les données obtenues chez la souris, le rat et le singe ont été intégrées, et des méthodes d'extrapolation interspécifiques ont été utilisées pour prédire la première dose administrée chez l'humain (FIH). Concernant la phénylcétonurie (PCU), les prédictions se sont principalement appuyées sur un modèle pertinent pour la maladie : le modèle murin PAHenu2.
Comme indiqué dans le tableau 1 ci-dessous, d'après les résultats de la modélisation PK/PD, les doses initiales chez l'homme (FIH) estimées pour les trois thérapies à ARNm (ARNm-3927, ARNm-3705 et ARNm-3210) sont respectivement de 0,3 mg/kg, 0,1 mg/kg et 0,4 mg/kg. Ces valeurs sont significativement inférieures aux doses sans effet indésirable observé (DSEIO) correspondantes : PA 3 mg/kg, MMA 5 mg/kg et PKU 3 mg/kg, ce qui représente des marges de sécurité respectives de 10, 50 et 7,5 et témoigne d'un excellent potentiel de sécurité clinique.
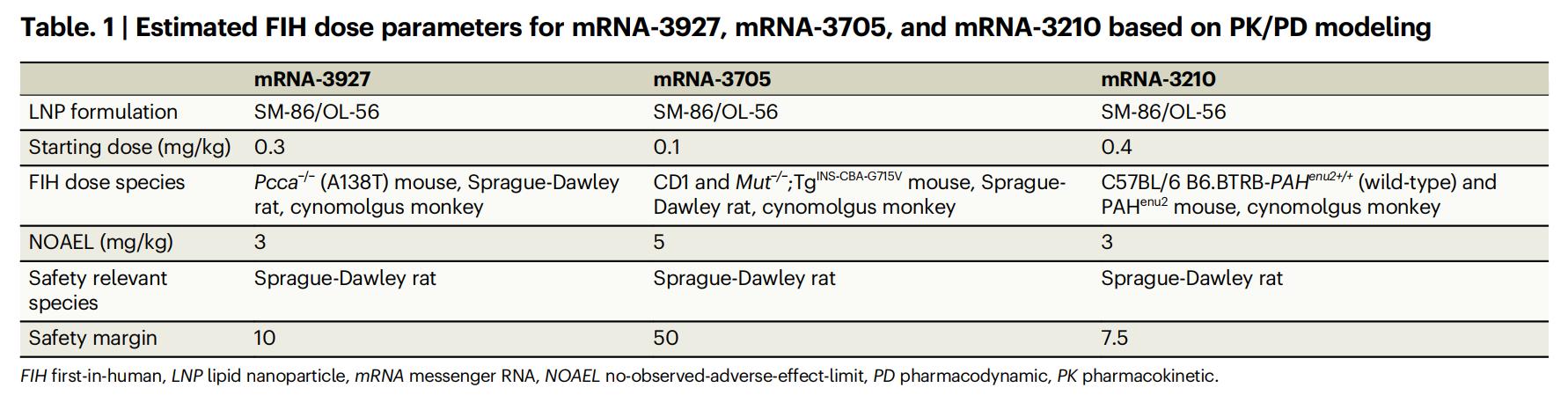
Tableau 1 : Paramètres de dose FIH estimés pour l'ARNm-3927, l'ARNm-3705 et l'ARNm-3210 basés sur la modélisation PK/PD
Récemment, une équipe de recherche dirigée par le professeur Zhan Changyou de l'École des sciences médicales fondamentales de l'Université Fudan a également publié une étude connexe sur les lipides PEG à terminaisons OH dans la revue en ligne bioRxiv. Cette étude a exploré de manière systématique le potentiel novateur des lipides PEG à terminaisons hydroxyle (OH-terminales) pour échapper à la reconnaissance par les anticorps anti-PEG préexistants chez l'humain. Grâce à un criblage systématique d'un large échantillon de sérums cliniques multicentriques, la recherche a révélé que la reconnaissance des matériaux PEG par les anticorps anti-polyéthylène glycol (anti-PEG), largement répandus dans la population, présente une sélectivité terminale significative. Parmi ces lipides, l'hydroxy-PEG (HO-PEG) a démontré une capacité d'« échappement immunitaire » exceptionnelle, évitant significativement la liaison avec les anticorps anti-PEG préexistants.
Cette étude a utilisé de manière exhaustive les techniques ELISA, la calorimétrie de titration isotherme (ITC) et divers tests fonctionnels in vitro pour comparer systématiquement les caractéristiques de liaison des matériaux PEG présentant différentes structures terminales (notamment MeO-, HO-, NH₂- et COOH-PEG) aux anticorps. Les résultats présentés dans la figure ci-dessous montrent que le HO-PEG a affiché les taux d'immunoréconnaissance les plus faibles dans tous les tests, avec une réduction des signaux de liaison positifs de plus de 90 %. De manière particulièrement remarquable, les comparaisons inter-espèces ont révélé que les anticorps humains préexistants reconnaissent principalement la structure terminale du PEG, tandis que les anticorps induits chez les modèles animaux ciblent souvent les unités répétitives du PEG. Cette différence majeure suggère que les avantages du HO-PEG résident dans sa haute spécificité et son important potentiel translationnel en clinique.
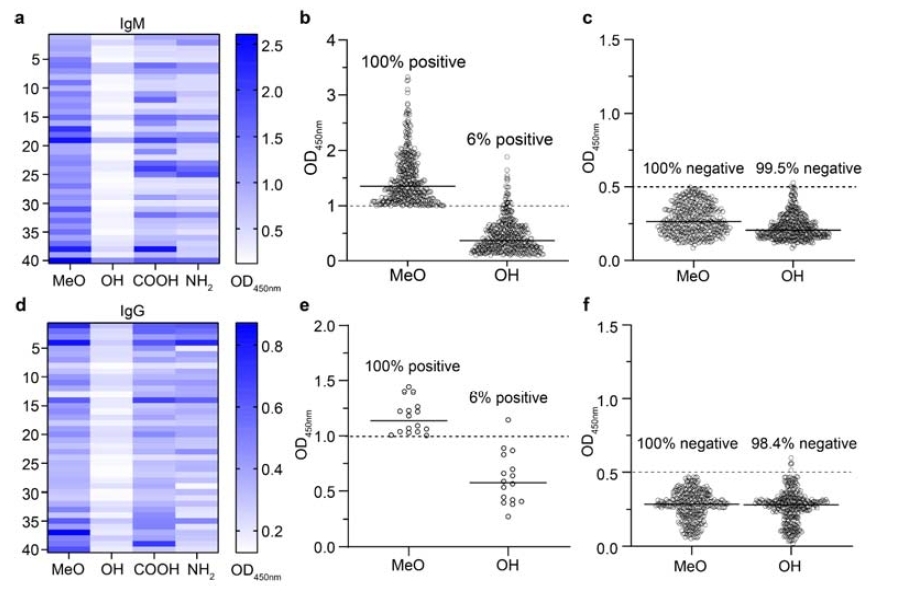
Figure : Sélectivité terminale des anticorps anti-PEG préexistants chez l'homme
En résumé, cette étude a démontré que, comparativement au méthoxy-PEG (MeO-PEG) traditionnel, les nanoparticules lipidiques (LNP) modifiées par HO-PEG permettent de réduire considérablement l'activation du complément, de diminuer la production d'anaphylatoxines, d'améliorer significativement la stabilité plasmatique des LNP et de réduire leur capture par les macrophages non cibles dans le sérum humain positif pour les anticorps. Ces améliorations constituent une nouvelle stratégie prometteuse pour optimiser l'efficacité de délivrance et la performance in vivo des médicaments à base de LNP, tout en réduisant les effets secondaires immunologiques cliniques.
Les études menées par Moderna et l'Université Fudan confirment l'importance des lipides PEG à terminaisons hydroxyle comme excipients clés pour améliorer la sécurité des formulations et réduire les réponses immunitaires. L'adoption de tels matériaux lipidiques fonctionnels avancés représente une voie essentielle pour le développement des systèmes d'administration de médicaments à base d'acides nucléiques de nouvelle génération.
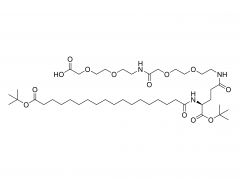
SINOPEG fournit non seulement des lipides HO-PEG, mais propose également d'autres structures de lipides PEG novatrices : DSPE-PEG-MAL, GaINAC-PEG-C-DSG, OL-56 (HO-PEG-Ste), mPEG-C16-céramide, mPEG-DHE-, Biotin-PEG-DMG, DMG-PEG-MAL, HO-PEG-VE, DMG-PEG-Mannose, DSPE-PEG-Galnac, mPEG-DPPE(14:0 PEG2000), mPEG-DMPE(16:0 PEG2000 PE-2K), mPEG-DOPE(18:1 PEG2000 PE-2K).