Dans le domaine biomédical, la thérapie CAR-T connaît une avancée majeure, passant de la préparation in vitro à la programmation in vivo. L'année 2025 marque un tournant décisif dans le développement des CAR-T in vivo. En juin, Capstan a annoncé que sa thérapie CAR-T in vivo, le CPTX2309, basée sur le vecteur tLNP, était entrée officiellement en phase I des essais cliniques. Par la suite, AbbVie a acquis Capstan pour 2,1 milliards de dollars en numéraire, obtenant ainsi sa plateforme technologique propriétaire tLNP. Cette transaction témoigne de la forte reconnaissance de la thérapie CAR-T in vivo par les grandes entreprises pharmaceutiques et marque le passage officiel de cette technologie du stade de la preuve de concept à une nouvelle phase de développement clinique.
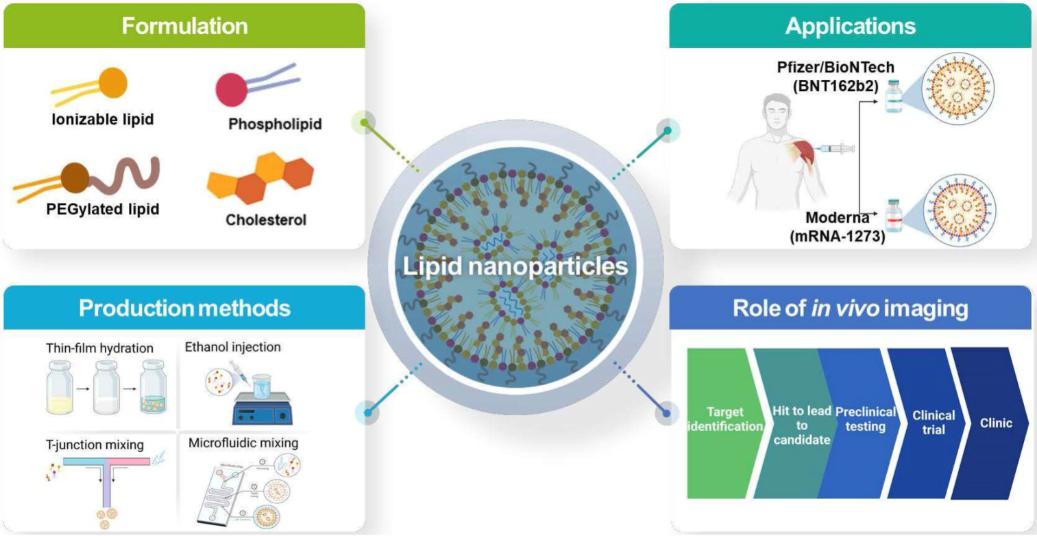
Thérapie CAR-T in vivo et tLNP : la prochaine tendance en médecine de précision
Contexte industriel : Un saut révolutionnaire du in vitro au in vivo
L'immunothérapie CAR-T in vitro traditionnelle a permis des avancées remarquables dans le traitement des leucémies à cellules B et des lymphomes, mais son processus de fabrication complexe, son coût élevé et sa toxicité constituent des freins à la généralisation de cette technologie. Selon une étude de marché, le prix d'un produit CAR-T commercial peut atteindre 370 000 à 470 000 dollars américains, et le délai entre le prélèvement des cellules et leur réinfusion est de 3 à 5 semaines. Certains patients ne peuvent pas attendre en raison de la progression rapide de leur maladie.
La thérapie CAR-T in vivo, grâce à une approche technologique révolutionnaire, délivre directement les gènes CAR dans l'organisme via des vecteurs spécifiques, court-circuitant ainsi les étapes complexes de culture in vitro et réalisant la « mise à niveau » des lymphocytes T directement chez le patient. Ce modèle de « production intracellulaire » simplifie considérablement le processus de traitement et devrait en réduire le coût à un dixième de celui de la thérapie CAR-T traditionnelle, marquant une avancée majeure pour la prochaine génération d'immunothérapie cellulaire.
tLNP : Le système d’administration principal pour les CAR-T in vivo
Dans le cadre de la mise en œuvre de la thérapie CAR-T in vivo, les nanoparticules lipidiques ciblées (tLNP) sont devenues la principale voie technique utilisée dans l'industrie. Les tLNP confèrent aux LNP traditionnelles la capacité de reconnaître et de délivrer précisément leur charge génétique aux lymphocytes T en modifiant leur surface avec des ligands de ciblage spécifiques (tels que des anticorps et des peptides).
La technologie de base repose sur le couplage précis de l'anticorps ciblé à la surface des LNP pour former un système de délivrance comparable à un « missile guidé ». Lorsque les tLNP pénètrent dans l'organisme, le ligand ciblé à leur surface guide la nanoparticule entière vers les lymphocytes T, puis y délivre l'ARNm CAR par endocytose, permettant ainsi la reprogrammation in situ des lymphocytes T.
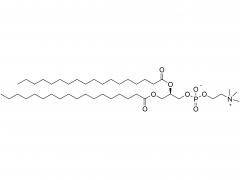
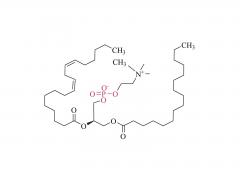
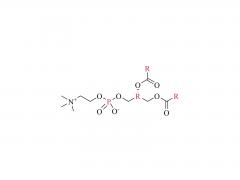
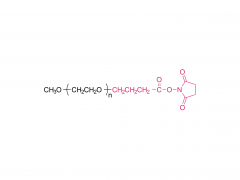
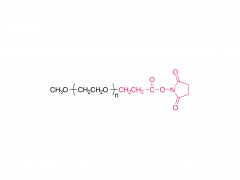
DSPE-PEG-MAL
Le « pont chimique » clé pour la construction de tLNP
Pilotage de la livraison ciblée : triple renforcement de la fonctionnalisation tLNP
Dans le système complexe de construction des tLNP, le DSPE-PEG-MAL joue un rôle d'« exécuteur » dynamique. Sa conception structurale correspond précisément à ses fonctions clés dans le processus de préparation, et son rôle peut être décomposé en trois étapes progressives et cohérentes.
• Enrobage et ancrage : positionnement précis de la solution à la phase membranaire
Lors de l'auto-assemblage des LNP, le DSPE-PEG-MAL s'ancre spontanément à la membrane bicouche lipidique en formation grâce aux propriétés physico-chimiques de sa queue hydrophobe DSPE. Ce processus garantit l'intégration de la molécule entière à la structure des LNP selon une orientation prédéfinie et de manière stable, jetant ainsi les bases de ses fonctions ultérieures.
• Étirement et protection : Établir des lignes de défense spatiales à l'interface
Une fois ancrées, les chaînes hydrophiles de PEG2000 s'étendent entièrement dans le milieu aqueux entourant la LNP, formant une couche protectrice flexible et hydratée, semblable à une brosse. Cette couche protectrice constitue la première ligne de défense de la LNP, maintenant sa stabilité physico-chimique et son intégrité fonctionnelle dans l'environnement complexe in vivo en inhibant l'adsorption non spécifique des protéines et en réduisant l'agrégation des particules, prolongeant ainsi leur demi-vie de circulation dans l'organisme.
• Clic et autonomisation : la transformation chimique des vecteurs généraux aux missiles de précision
Le groupe maléimide (-MAL) situé à l'extrémité de la chaîne PEG constitue l'interrupteur chimique qui confère aux LNP leur « intelligence ». En tant que site de biocouplage hautement sélectif, il peut réagir efficacement avec les groupes thiols d'anticorps modifiés (par exemple, introduits par réduction de ponts disulfure ou à l'aide de réactifs tels que le SATA). C'est précisément grâce à cette étape de liaison covalente irréversible que les LNP ordinaires sont « activées » et évoluent en LNP ciblées, capables de reconnaître avec précision des antigènes spécifiques de surface cellulaire.
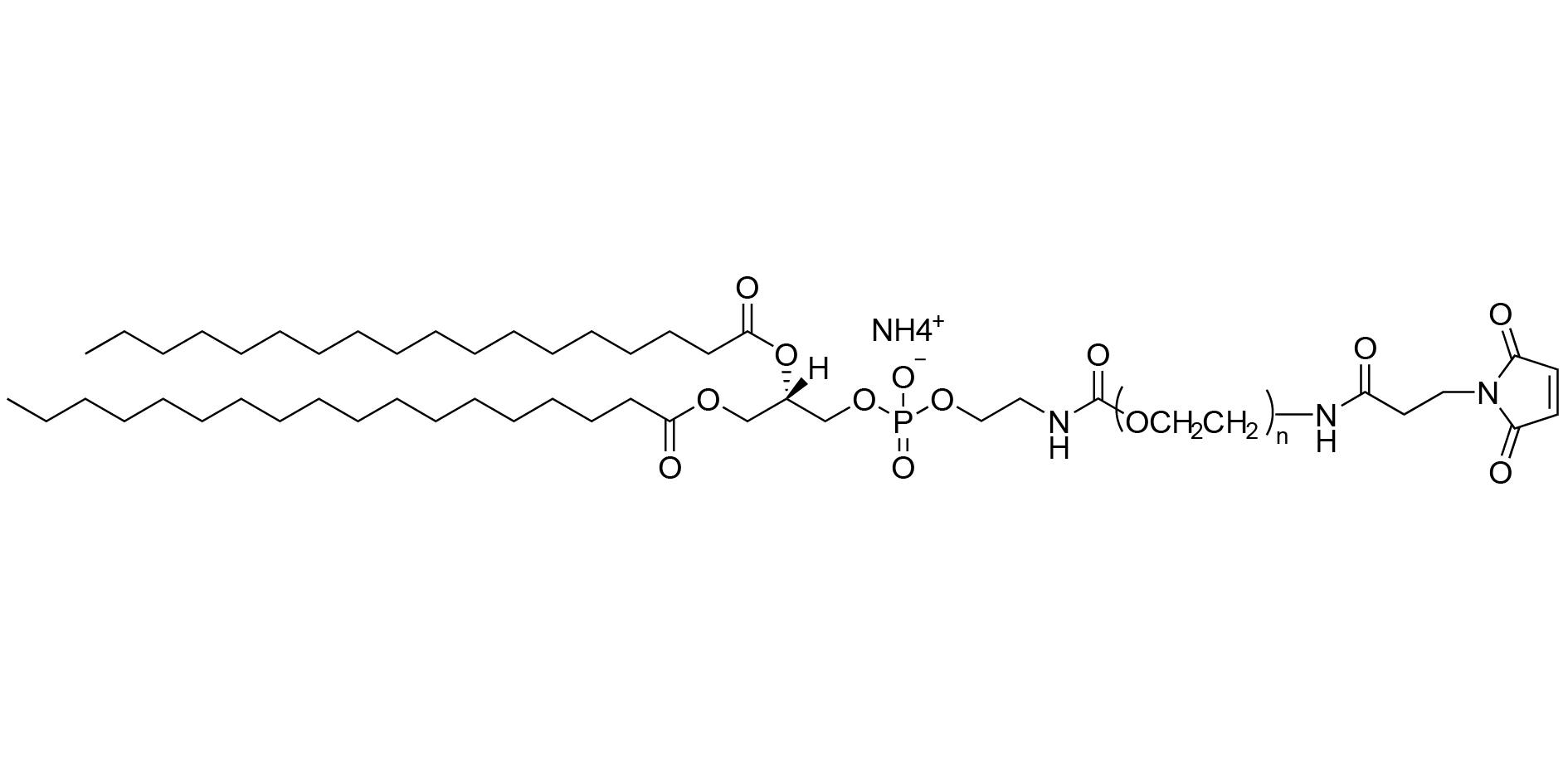
Figure 1 : Schéma de la structure moléculaire du DSPE-PEG-MAL (sel d'ammonium)
Approche technique pour la conjugaison d'anticorps à la surface de LNP
L’utilisation de DSPE-PEG-MAL pour la conjugaison d’anticorps à la surface des LNP est actuellement la stratégie la plus aboutie et la plus répandue pour la construction de tLNP. Ce procédé comprend généralement trois liaisons principales :
Préparation des LNP : le DSPE-PEG-MAL est mélangé à d’autres composants lipidiques (lipides ionisables, lipides auxiliaires, cholestérol, lipides PEG) par une technologie de mélange microfluidique afin de préparer les LNP. Le groupe maléimide (-MAL) du DSPE-PEG-MAL est alors exposé à la surface des LNP.
2. Prétraitement des anticorps : Conformément aux méthodes courantes de construction de LNPS ciblés dans l'industrie (telles que décrites par Capstan Therapeutics dans le brevet WO2024249954), les anticorps sont modifiés avec du thiol (-SH) pour préparer la réaction de couplage ultérieure.
3. Réaction de couplage : L’anticorps conjugué au thiol (-SH) est incubé avec les LNP dans un tampon approprié (par exemple, du PBS, pH 7,4) à basse température (par exemple, 4 °C) (généralement pendant plusieurs heures, voire une nuit). Les groupements thiol de l’anticorps se lient de manière covalente aux groupements maléimide (-MAL) à la surface des LNP, finalisant ainsi la modification de fonctionnalisation ciblée.
Comparé aux vecteurs viraux tels que les lentivirus et les virus adéno-associés, le système d'administration LNP basé sur le DSPE-PEG-MAL présente des avantages tels qu'une faible immunogénicité, l'absence de risque de mutation d'insertion et une production à grande échelle facile, ce qui en fait un vecteur idéal pour les CAR-T in vivo.
Les principaux avantages du DSPE-PEG-MAL de qualité BPF de SINOPEG
Production conforme aux BPF et approvisionnement immédiat
Dans le contexte actuel de recherche et développement sur les thérapies CAR-T in vivo, la disponibilité d'excipients clés de haute qualité et pérennes est essentielle au bon déroulement des opérations. Xiamen SINOPEGe a mis en place un système de gestion de la qualité conforme aux BPF (Bonnes Pratiques de Fabrication), a réussi la production à grande échelle de DSPE-PEG-MAL selon les normes BPF et a constitué un stock suffisant.
Le double dépôt pour CDE et DMF est sur le point d'être finalisé.
Afin de mieux accompagner nos clients dans leurs demandes d'enregistrement de médicaments, notre produit DSPE-PEG-MAL fait l'objet d'une promotion active :
• Enregistrement et dépôt des excipients auprès du CDE chinois : une fois la procédure terminée, elle peut être directement associée aux demandes d’autorisation de mise sur le marché des médicaments.
• Dépôt du DMF auprès de la FDA aux États-Unis : fournit une base faisant autorité pour prouver la qualité et la conformité des excipients aux exigences de la FDA.
SINOPEG a mis en place un système de contrôle qualité complet, depuis l'approvisionnement en matières premières jusqu'à la purification, en passant par les procédés de synthèse. Nous sommes pleinement conscients que, pour les thérapies de pointe comme les cellules CAR-T in vivo, la moindre différence dans les excipients peut avoir un impact considérable sur les propriétés physico-chimiques, le comportement in vivo et même l'effet thérapeutique de la formulation finale. Nous contrôlons rigoureusement la pureté, l'activité du groupe maléimide (-MAL) et l'intégrité de la chaîne PEG. De plus, forts de notre expertise en production industrielle de PEG et de dérivés actifs acquise au fil des années et de notre expérience dans le dépôt de nombreuses demandes d'autorisation de mise sur le marché (AMM), nous avons développé une série de tests de caractérisation spécifiques. Ces caractérisations approfondies des propriétés physico-chimiques offrent des avantages considérables et permettent de fournir des données plus complètes pour votre demande d'AMM. Une fois le double dépôt effectué, vous pouvez utiliser directement notre numéro de dossier, ce qui simplifie considérablement les procédures de dépôt d'AMM (demande d'autorisation de mise sur le marché d'un nouveau médicament) et d'essai clinique (IND), vous faisant gagner du temps et de l'argent, et augmentant significativement le taux de réussite de vos demandes.
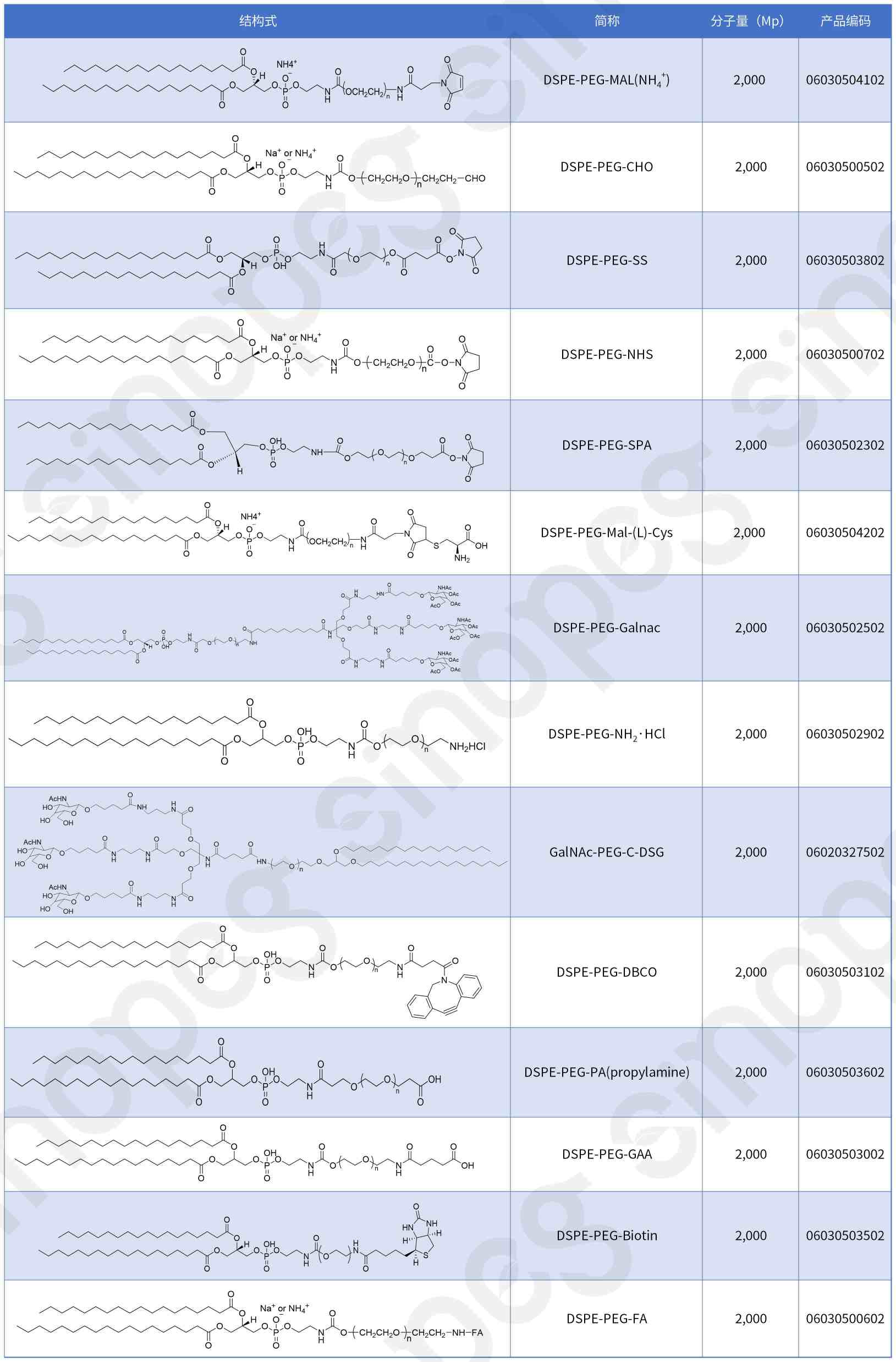
Extension de la gamme de produits DSPE-PEG
En plus du DSPE-PEG-MAL, notre société peut également fournir des services de développement personnalisés pour une variété de dérivés de phospholipides-PEG fonctionnalisés afin de répondre à différents besoins en R&D.
Référence:
1. Capstan Therapeutics. Capstan Therapeutics annonce le lancement d'un essai de phase 1 de son traitement CAR-T in vivo phare, le CPTX2309, pour le traitement des maladies auto-immunes. Business Wire. 11 juin 2025.
2. AbbVie. AbbVie va acquérir Capstan Therapeutics, renforçant ainsi son engagement à transformer les soins aux patients en immunologie. Centre d'actualités AbbVie. 30 juin 2025.
3. Société américaine d'oncologie clinique. Thérapie par cellules CAR-T : coûts et considérations. Actes de la réunion annuelle de l'ASCO. 2024.
4. Smith J, et al. Les cellules CAR-T in vivo démontrent une puissante activité antitumorale avec une complexité de fabrication réduite. Nature Biotechnology. 2023;41(5):678-685.
5. Wang D, et al. Nanoparticules lipidiques ciblées pour l'ingénierie des cellules T in vivo. Science Advances. 2024;10(12):eadl2165.
6. Chen X, et al. LNP conjugués à des anticorps pour une délivrance précise de gènes in vivo aux cellules T. Cell Reports Medicine. 2024;5(3):101489.
7. Zhang Y, et al. Structure moléculaire et propriétés d'ancrage membranaire des lipides DSPE-PEG. Biochimica et Biophysica Acta. 2023;1865(4):184321.
8. Gabizon A, et al. Durée de circulation prolongée et accumulation accrue dans les exsudats malins de la doxorubicine encapsulée dans des liposomes recouverts de polyéthylène glycol. Cancer Research. 1994;54:987-992.
9. Hermanson GT. Techniques de bioconjugaison. 3e éd. Academic Press; 2021.
10. Wei X, et al. Synthèse microfluidique de nanoparticules lipidiques ciblées pour l'ingénierie des cellules T. Lab on a Chip. 2024;24(8):2156-2168.
11. Kato T, et al. Conjugaison efficace d'anticorps à l'aide du réactif de Traut pour la fonctionnalisation des LNP. Bioconjugate Chemistry. 2023;34(7):1256-1265.
12. Li M, et al. Conjugaison covalente d'anticorps à la surface de LNP pour une délivrance ciblée. Journal of Controlled Release. 2024;368:456-467.
13. Xu Q, et al. Systèmes de délivrance non viraux pour l'ingénierie des cellules CAR-T in vivo. Nature Reviews Materials. 2024;9(3):189-205.