– Le patisiran a atteint le critère d'évaluation principal avec une amélioration statistiquement significative du test de marche de 6 minutes par rapport au placebo à 12 mois –
– Patisiran a également atteint le premier critère d'évaluation secondaire avec une amélioration statistiquement significative de la qualité de vie, telle que mesurée par le questionnaire sur la cardiomyopathie de Kansas City, par rapport au placebo à 12 mois –
– Patisiran a démontré un profil d'innocuité et de tolérabilité encourageant chez les patients atteints d'amylose ATTR avec cardiomyopathie –
– La société prévoit de déposer une demande supplémentaire de nouveau médicament aux États-Unis fin 2022 –
– Des données complètes seront présentées au 18e Symposium international sur l'amylose –
– Alnylam organisera une conférence téléphonique aujourd'hui à 8h00 HE –
CAMBRIDGE, Mass.--( BUSINESS WIRE )-- Alnylam Pharmaceuticals, Inc. (Nasdaq : ALNY), la principale société thérapeutique à base d'ARNi, a annoncé aujourd'hui que l'étude de phase 3 APOLLO-B portant sur le patisiran, un agent thérapeutique expérimental à base d'ARNi en cours de développement pour le traitement de l'amylose médiée par la transthyrétine (ATTR) avec cardiomyopathie, a atteint le critère principal de changement par rapport au départ dans le test de marche de 6 minutes (6-MWT) à 12 mois par rapport au placebo (valeur de p 0,0162). L'étude a également atteint le premier critère d'évaluation secondaire de changement par rapport au départ de la qualité de vie par rapport au placebo, tel que mesuré par le Kansas City Cardiomyopathy Questionnaire (KCCQ) (valeur de p 0,0397).
"Nous sommes ravis qu'APOLLO-B ait atteint avec succès tous ses objectifs majeurs, ce qui, selon nous, valide pour la première fois l'hypothèse selon laquelle l'inactivation du TTR par un traitement ARNi peut être une approche efficace pour traiter la cardiomyopathie de l'amylose ATTR"
Tweet ça
L'étude comprenait également des critères d'évaluation composites secondaires supplémentaires à tester de manière hiérarchique. Un résultat non significatif (valeur de p 0,0574) a été trouvé sur le critère d'évaluation composite secondaire de la mortalité toutes causes confondues, de la fréquence des événements cardiovasculaires et du changement par rapport à la ligne de base du 6-MWT sur 12 mois par rapport au placebo . En conséquence, aucun test statistique formel n'a été effectué sur les deux derniers critères d'évaluation composites, qui n'étaient pas alimentés pour une signification statistique compte tenu de la courte durée de l'étude - mortalité toutes causes confondues et fréquence des hospitalisations toutes causes confondues et des visites urgentes pour insuffisance cardiaque chez les patients pas sur tafamidis au départ (valeur de p nominale 0,9888) et dans la population globale (valeur de p nominale 0,5609). Le patisiran a également démontré un profil d'innocuité et de tolérabilité encourageant, les décès favorisant numériquement le bras patisiran.
« Nous sommes ravis qu'APOLLO-B ait atteint avec succès tous ses objectifs majeurs, ce qui, selon nous, valide pour la première fois l'hypothèse selon laquelle le silençage du TTR par un traitement ARNi peut être une approche efficace pour traiter la cardiomyopathie de l'amylose ATTR », a déclaré Pushkal Garg, MD, médecin-chef d'Alnylam. « L'amylose ATTR avec cardiomyopathie est une cause de plus en plus reconnue d'insuffisance cardiaque, affectant plus de 250 000 patients dans le monde. Ces patients ont des options de traitement limitées et la progression de la maladie est courante. En tant que tel, nous sommes encouragés à voir le potentiel du patisiran pour améliorer la capacité fonctionnelle et la qualité de vie des patients vivant avec cette maladie mortelle multisystémique. Je tiens à remercier tous les patients, les soignants, les chercheurs et le personnel de l'étude qui ont participé et continuent de participer à APOLLO-B.
APOLLO-B est une étude mondiale multicentrique de phase 3, randomisée, en double aveugle et contrôlée par placebo, conçue et alimentée pour évaluer les effets du patisiran sur la capacité fonctionnelle et la qualité de vie des patients atteints d'amylose ATTR avec cardiomyopathie. L'étude a recruté 360 patients adultes atteints d'amylose ATTR (héréditaire ou de type sauvage) atteints de cardiomyopathie sur 69 sites dans 21 pays. Les patients ont été randomisés 1:1 pour recevoir 0,3 mg/kg de patisiran ou un placebo administré par voie intraveineuse toutes les trois semaines sur une période de traitement en double aveugle de 12 mois. Après 12 mois, tous les patients recevront du patisiran dans une période d'extension en ouvert.
Le critère d'évaluation principal d'APOLLO-B est le changement par rapport à la ligne de base du 6-MWT à 12 mois par rapport au placebo. Les critères de jugement secondaires évaluent l'efficacité du patisiran versus placebo sur 12 mois de manière hiérarchique avec les mesures suivantes :
Les critères d'évaluation exploratoires comprenaient des biomarqueurs cardiaques et divers outils d'imagerie pour mieux caractériser le fardeau potentiel de l'atteinte cardiaque chez ces patients.
Le profil d'innocuité global du patisiran au cours de la période de 12 mois en double aveugle était encourageant.
« Je suis ravi des résultats de l'étude APOLLO-B, qui suggèrent que le patisiran pourrait être une option de traitement pour les patients atteints d'amylose ATTR avec cardiomyopathie, en supposant un examen réglementaire favorable. De plus, les données APOLLO-B renforcent encore notre confiance dans notre étude de phase 3 HELIOS-B sur le vutrisiran dans l'amylose ATTR avec cardiomyopathie, qui devrait être publiée début 2024 », a déclaré Yvonne Greenstreet, MBChB, directrice générale d'Alnylam. . « Les résultats positifs d'aujourd'hui font avancer notre objectif d'établir une franchise TTR leader du secteur, qui comprend actuellement ONPATTRO ® et AMVUTTRA TM pour la polyneuropathie de l'amylose ATTR héréditaire. Nous pensons que ces données nous rapprochent un peu plus de la réalisation de notre Alnylam P 5vision x25 de devenir une entreprise biopharmaceutique de premier plan.
Les résultats complets de l'étude APOLLO-B seront présentés dans le cadre d'une session de dernière minute lors du 18e Symposium international sur l'amylose le 8 septembre 2022 à Heidelberg, en Allemagne.
Patisiran est le nom établi d'ONPATTRO, qui est approuvé aux États-Unis et au Canada pour le traitement de la polyneuropathie de l'amylose hATTR chez l'adulte. ONPATTRO est également approuvé dans l'Union européenne, en Suisse et au Brésil pour le traitement de l'amylose hATTR chez les adultes atteints de polyneuropathie de stade 1 ou de stade 2, et au Japon pour le traitement de l'amylose hATTR avec polyneuropathie.
Informations sur la conférence téléphonique
La direction discutera des principaux résultats d'APOLLO-B par conférence téléphonique le mercredi 3 août 2022 à 8h00 HE. Pour accéder à l'appel, veuillez vous inscrire en ligne sur https://register.vevent.com/register/BI6ac74b5406af42c5980ba67c6f9e419d . Les participants sont priés de s'inscrire au moins 15 minutes avant le début de l'appel. Une rediffusion de l'appel sera disponible deux heures après l'appel et archivée sur la même page Web pendant six mois.
Une webdiffusion audio en direct de l'appel sera disponible dans la section Investisseurs du site Web de la Société à l'adresse www.alnylam.com/events . Une webdiffusion archivée sera disponible sur le site Web de la Société environ deux heures après l'événement.
À propos de l'amylose ATTR
L'amylose médiée par la transthyrétine (ATTR) est une maladie rare, rapidement progressive et débilitante causée par des protéines de transthyrétine (TTR) mal repliées qui s'accumulent sous forme de fibrilles amyloïdes dans plusieurs tissus, notamment les nerfs, le cœur et le tractus gastro-intestinal (GI). Il existe deux types différents d'amylose ATTR - l'amylose héréditaire ATTR (hATTR), causée par une variante du gène TTR, et l'amylose ATTR de type sauvage (wtATTR), qui survient sans variante du gène TTR. L'amylose hATTR touche environ 50 000 personnes dans le monde, tandis que l'amylose wtATTR est estimée toucher 200 000 à 300 000 personnes dans le monde.
À propos d'ONPATTRO® ( Patisiran)
ONPATTRO est un ARNi thérapeutique approuvé aux États-Unis et au Canada pour le traitement de la polyneuropathie de l'amylose hATTR chez l'adulte. ONPATTRO est également approuvé dans l'Union européenne, en Suisse et au Brésil pour le traitement de l'amylose hATTR chez les adultes atteints de polyneuropathie de stade 1 ou de stade 2, et au Japon pour le traitement de l'amylose hATTR avec polyneuropathie. ONPATTRO est un ARNi thérapeutique ciblant la transthyrétine (TTR) administré par voie intraveineuse. Il est conçu pour cibler et faire taire l'ARN messager TTR, réduisant ainsi la production de protéine TTR avant sa fabrication. La réduction de la protéine pathogène entraîne une réduction des dépôts amyloïdes dans les tissus. Pour plus d'informations sur ONPATTRO, y compris les informations de prescription complètes , visitez ONPATTRO.com .
Indication ONPATTRO et ISI
Indication
ONPATTRO est indiqué dans le traitement de la polyneuropathie de l'amylose héréditaire à transthyrétine chez l'adulte.
Informations importantes sur l'innocuité
Réactions liées à la perfusion
Des réactions liées à la perfusion (IRR) ont été observées chez des patients traités par ONPATTRO. Dans une étude clinique contrôlée, 19 % des patients traités par ONPATTRO ont présenté des RLP, contre 9 % des patients traités par placebo. Les symptômes les plus courants des RLP avec ONPATTRO étaient les bouffées vasomotrices, les maux de dos, les nausées, les douleurs abdominales, la dyspnée et les maux de tête.
Pour réduire le risque de RLP, les patients doivent recevoir une prémédication avec un corticostéroïde, de l'acétaminophène et des antihistaminiques (bloquants H1 et H2) au moins 60 minutes avant la perfusion d'ONPATTRO. Surveiller les patients pendant la perfusion pour détecter les signes et symptômes de RLP. Si une RLP se produit, envisagez de ralentir ou d'interrompre la perfusion et d'instaurer une prise en charge médicale selon les indications cliniques. Si la perfusion est interrompue, envisager de reprendre à un débit de perfusion plus lent uniquement si les symptômes ont disparu. En cas de RLP grave ou menaçant le pronostic vital, la perfusion doit être interrompue et non reprise.
Réduction des taux sériques de vitamine A et supplémentation recommandée
Le traitement ONPATTRO entraîne une diminution des taux sériques de vitamine A. Une supplémentation à l'apport journalier recommandé (AJR) de vitamine A est conseillée pour les patients prenant ONPATTRO. Des doses supérieures à la RDA ne doivent pas être administrées pour tenter d'atteindre des taux sériques normaux de vitamine A pendant le traitement par ONPATTRO, car les taux sériques ne reflètent pas la quantité totale de vitamine A dans l'organisme.
Les patients doivent être adressés à un ophtalmologiste s'ils développent des symptômes oculaires évocateurs d'une carence en vitamine A (par exemple, cécité nocturne).
Effets indésirables
Les effets indésirables les plus fréquents survenus chez les patients traités par ONPATTRO étaient les infections des voies respiratoires supérieures (29 %) et les réactions liées à la perfusion (19 %).
À propos de la technologie LNP
Alnylam détient des licences sur la propriété intellectuelle d'Arbutus Biopharma LNP pour une utilisation dans des produits thérapeutiques ARNi utilisant la technologie LNP.
À propos de l'ARNi
L'ARNi (interférence ARN) est un processus cellulaire naturel de silençage génique qui représente aujourd'hui l'une des frontières les plus prometteuses et les plus avancées de la biologie et du développement de médicaments. Sa découverte a été annoncée comme "une percée scientifique majeure qui se produit une fois tous les dix ans environ" et a été récompensée par le prix Nobel 2006 de physiologie ou médecine. En exploitant le processus biologique naturel de l'ARNi se produisant dans nos cellules, une nouvelle classe de médicaments, connue sous le nom de thérapeutique ARNi, est désormais une réalité. Les petits ARN interférents (ARNsi), les molécules qui médient l'ARNi et composent la plateforme thérapeutique ARNi d'Alnylam, fonctionnent en amont des médicaments actuels en faisant taire l'ARN messager (ARNm) - les précurseurs génétiques - qui codent pour les protéines pathogènes, empêchant ainsi leur fabrication .
À propos d'Alnylam Pharmaceuticals
Alnylam (Nasdaq : ALNY) a dirigé la traduction de l'interférence ARN (ARNi) en une toute nouvelle classe de médicaments innovants avec le potentiel de transformer la vie des personnes atteintes de maladies rares et répandues avec des besoins non satisfaits. Basées sur une science lauréate du prix Nobel, les thérapies ARNi représentent une approche puissante et cliniquement validée produisant des médicaments transformateurs. Depuis sa création il y a 20 ans, Alnylam a mené la révolution ARNi et continue de concrétiser une vision audacieuse pour transformer la possibilité scientifique en réalité. Les produits thérapeutiques ARNi commerciaux d'Alnylam sont ONPATTRO ® (patisiran), GIVLAARI ® (givosiran), OXLUMO ® (lumasiran), AMVUTTRA ™ (vutrisiran) et Leqvio ®(inclisiran) développé et commercialisé par le partenaire d'Alnylam, Novartis. Alnylam dispose d'un vaste portefeuille de médicaments expérimentaux, y compris plusieurs produits candidats en phase de développement avancé. Alnylam met en œuvre sa stratégie « Alnylam P 5 x25 » pour fournir des médicaments transformateurs dans les maladies rares et courantes au profit des patients du monde entier grâce à une innovation durable et à des performances financières exceptionnelles, résultant en un profil biotechnologique de premier plan. Alnylam a son siège social à Cambridge, MA. Pour plus d'informations sur nos employés, la science et le pipeline, veuillez visiter www.alnylam.com et communiquer avec nous sur Twitter à @Alnylam , sur LinkedIn ou sur Instagram .
Énoncés prospectifs d'Alnylam
Diverses déclarations dans ce communiqué concernant les attentes, plans et perspectives futurs d'Alnylam, y compris, sans s'y limiter, les opinions d'Alnylam concernant la sécurité et l'efficacité du patisiran pour le traitement de l'amylose ATTR avec cardiomyopathie, le potentiel du patisiran pour améliorer la capacité fonctionnelle et la qualité de vie des patients atteints d'amylose ATTR avec cardiomyopathie, le moment prévu de la présentation des données complètes de l'étude APOLLO-B et du dépôt d'un sNDA pour le patisiran aux États-Unis, l'opportunité de marché potentielle pour le patisiran s'il est approuvé par les autorités réglementaires pour traiter l'amylose ATTR avec cardiomyopathie, l'évaluation du vutrisiran dans l'étude de phase 3 HELIOS-B pour le traitement des patients atteints d'amylose ATTR avec cardiomyopathie et le calendrier prévu pour les données de cette étude,et l'aspiration d'Alnylam à devenir une entreprise biotechnologique de premier plan et la réalisation prévue de son "Alnylam P 5 x25», constituent des déclarations prospectives aux fins des dispositions d'exonération en vertu de la Private Securities Litigation Reform Act de 1995. Les résultats réels et les plans futurs peuvent différer sensiblement de ceux indiqués par ces déclarations prospectives en raison de divers risques importants , les incertitudes et d'autres facteurs, y compris, sans s'y limiter : l'impact direct ou indirect de la pandémie mondiale de COVID-19 ou de toute pandémie future sur les activités, les résultats d'exploitation et la situation financière d'Alnylam et l'efficacité ou la rapidité des efforts d'Alnylam pour atténuer l'impact de la pandémie ; l'impact potentiel de la récente transition du leadership sur la capacité d'Alnylam à attirer et retenir les talents et à exécuter avec succès sa stratégie « Alnylam P5x25 » ; Alnylam' s sa capacité à découvrir et à développer de nouveaux candidats-médicaments et approches d'administration et à démontrer avec succès l'efficacité et l'innocuité de ses produits candidats ; les résultats précliniques et cliniques de ses produits candidats, dont le patisiran et le vutrisiran ; les actions ou conseils des agences réglementaires et la capacité d'Alnylam à obtenir et à maintenir l'approbation réglementaire pour ses produits candidats, y compris le patisiran et le vutrisiran, ainsi qu'une tarification et un remboursement favorables ; lancer, commercialiser et vendre avec succès ses produits approuvés dans le monde ; les retards, interruptions ou défaillances dans la fabrication et la fourniture de ses produits candidats ou de ses produits commercialisés ; obtenir, conserver et protéger la propriété intellectuelle ; la capacité d'Alnylam à étendre avec succès l'indication d'ONPATTRO, d'AMVUTTRA ou d'OXLUMO à l'avenir ; Alnylam' s sa capacité à gérer sa croissance et ses charges d'exploitation grâce à des investissements disciplinés dans les opérations et sa capacité à atteindre un profil financier autonome à l'avenir sans avoir besoin de financement futur par actions ; la capacité d'Alnylam à maintenir des collaborations commerciales stratégiques ; la dépendance d'Alnylam vis-à-vis de tiers pour le développement et la commercialisation de certains produits, dont Novartis, Sanofi, Regeneron et Vir ; l'issue d'un litige ; l'impact potentiel des enquêtes gouvernementales en cours et le risque d'enquêtes futures ; et les dépenses imprévues ; ainsi que les risques discutés plus en détail dans les « Facteurs de risque » déposés avec le dernier rapport trimestriel d'Alnylam sur formulaire 10-Q déposé auprès de la Securities and Exchange Commission (SEC) et dans ses autres documents déposés auprès de la SEC. En outre, toute déclaration prospective représente les opinions d'Alnylam uniquement à ce jour et ne doit pas être considérée comme représentant ses opinions à une date ultérieure. Alnylam décline explicitement toute obligation, sauf dans la mesure requise par la loi, de mettre à jour les déclarations prospectives.
Patisiran n'a été approuvé par aucune agence de réglementation pour le traitement de l'amylose ATTR avec cardiomyopathie. Aucune conclusion ne peut ou ne doit être tirée concernant son innocuité ou son efficacité dans le traitement de la cardiomyopathie dans cette population.
Référence:
https://www.businesswire.com/news/home/20220803005528/en/
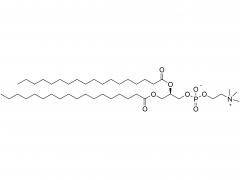
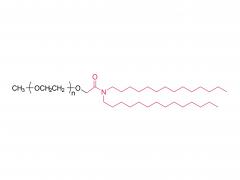
L'étude de phase 3 APOLLO-B sur le patisiran, un agent thérapeutique expérimental à base d'ARNi, a obtenu un résultat positif. Patisiran est formulé avec DLin-MC3-DMA et mPEG 2000 -C-DMG . SNIOPEG fournit des lipides LNP de haute qualité.